-
 Manipulation
Manipulation
-
 Galerie
Galerie
-
 Point
Point
-
 Sel
Sel
-
 Saccharose
Saccharose
La structure des minéraux est étudiée en classe de première S, dans le programme de Sciences Physiques et Chimie (programme 2011). Sont envisagées les notions de solide ionique et de solide moléculaire, ainsi que les interactions permettant le maintien de ces structures.
Selon le type de liaisons et le type de motif répété dans le cristal on peut distinguer différents types de cristaux
| Type de cristal | Forces de cohésion | Motif | Exemple |
|---|---|---|---|
| Moléculaire | Liaisons hydrogène, interactions de Van der Walls,... | Molécule | Glace (molécules d'eau assemblées par des liaisons H) |
| Métallique | Liaison métallique (électrons libres) | Atome métallique | Fer, Argent,... |
| Ionique | Force électrostatique | Ions | Sel, Quartz,... |
| Covalent | Liaison covalente | Atomes | Diamant, Graphite,... |
Les cristaux réalisés dans le cadre de ce projet sont donc de type ionique (sel) ou de type moléculaire (saccharose)
Dans ces solides, la cohésion est assurée par les forces électrostatiques liées aux charges portées par les cations et les anions du solide. La somme des charges est nulle. Les ions forment des empilements de cations et d'anions
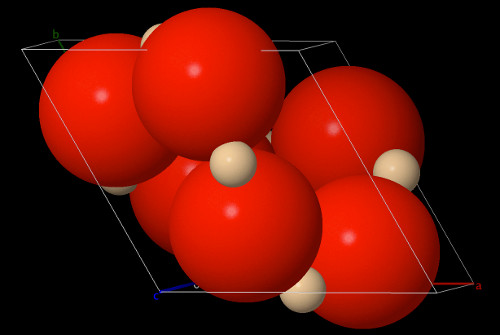
Dans cette maille les anions oxygène (O2-) et les cations Silicium (Si4+) sont représentés
suivant leurs rayons ioniques.
On peut constater que :
Dans ces solides, la cohésion est assurée par différentes forces dont les liaisons hydrogène. Les unités assemblées entre elles sont des molécules qui peuvent être ou non chargées.
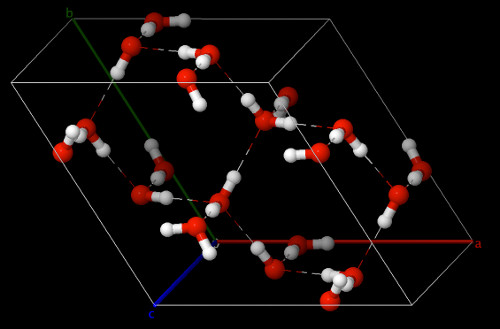
Dans cette maille, la cohésion est assurée par des liaisons hydrogènes entre les oxygènes qui possèdent une charge partielle négative et les atomes d'hydrogène à la charge partielle positive.
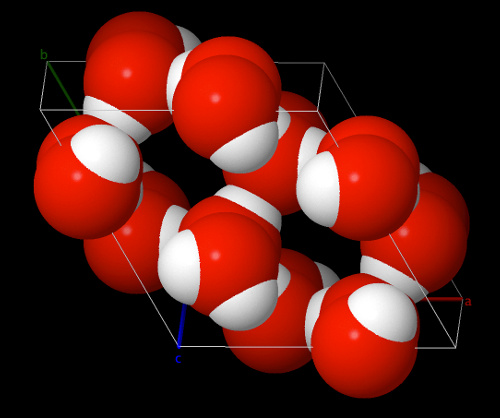
Ce mode de visualisation montre la faible distance entre molécules d'eau voisines (du fait des liaisons hydrogène) et l'importance de l'espace restant entre ces molécules. Les sphères de Van der Waals se recoupent, à la différence des sphères de rayon ionique.