-
 Manipulation
Manipulation
-
 Galerie
Galerie
-
 Point
Point
-
 Sel
Sel
-
 Saccharose
Saccharose
Les observations des cristaux de sel à la loupe et au microscope polarisant montrent une forme cubique recoupée
par de nombreuses figures de croissance. Un même motif est répété.
Par ailleurs, la cristallisation par chauffage est très rapide (en comparaison avec celle du saccharose).

L'utilisation du logiciel MinUSc
(Minéraux à Usage Scolaire)
permet de rechercher l'explication de ces propriétés à l'échelle moléculaire.
Le minéral correspondant au sel est appelé Halite et c'est sous ce terme qu'il est référencé dans MinUSc.
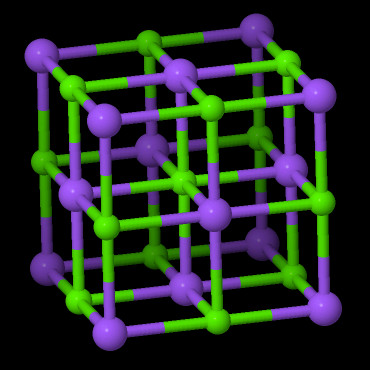
Chaque atome de sodium est entouré par 6 atomes de Chlore (site octaédrique).
La maille est de forme cubique (les mesures sont indiquées dans la fenêtre de visualisation de MinUSc).
Pour prendre conscience de la périodicité de la maille dans les 3 directions de l'espace, il est possible de
multiplier l'affichage des mailles selon les trois axes. Il est également possible d'utiliser le mode "Navigation"
pour changer le point de vue de l'observateur en le plaçant à l'intérieur du cristal :

L'empilement des atomes est visualisable en mode d'affichage "Sphères"
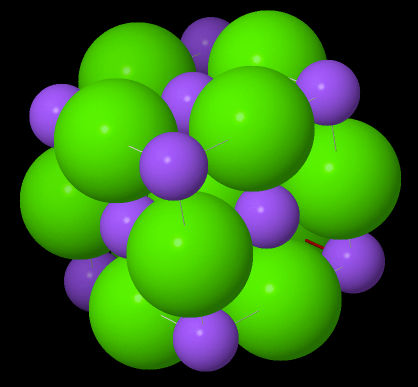
Les atomes de Chlore (en vert) ont le rayon ionique le plus important, et correspondent aux anions.
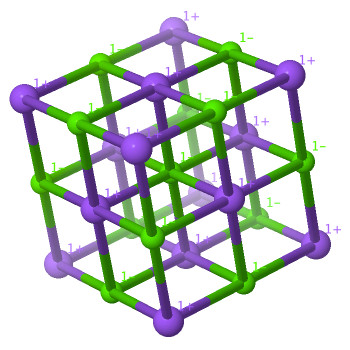
Chaque anion porte une charge positive et est entouré par 6 cations chargés positivement, et réciproquement.
Au total peut-on dire qu'il y a autant de charges positives que négatives ?
L'examen de cette maille permet en première approximation de dénombrer 14 ions sodium pour 13 ions chlorure.
Mais il faut garder à l'esprit que les atomes situés en bordure de maille sont partagés avec les mailles voisines
(2 mailles pour les faces, 4 mailles pour les arêtes et 8 mailles pour les sommets).
Le mode formule permet de contourner cette difficulté en effectuant un comptage des atomes partagés entre mailles :
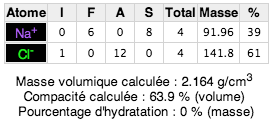
Ainsi il y a par maille autant d'atomes de chaque espèce chimique ce qui confirme l'équilibre des charges
Les dimensions de la maille sont indiquées dans la fenêtre de visualisation. Les rayons ioniques s'affichent au survol de l'atome en mode formule. Ces informations peuvent-être utilisées pour calculer les paramètres de l'empilement des sphères représentatives des atomes. En particulier le rapport entre l'espace occupé par les atomes et celui laissé vacant : cette grandeur est appelée compacité. Elle est utilisée pour comparer des empilements entre eux.