-
 Manipulation
Manipulation
-
 Galerie
Galerie
-
 Point
Point
-
 Sel
Sel
-
 Saccharose
Saccharose
Les observations des cristaux de saccharose montrent une forme différente du cube caractéristique du sel. Certains
cristaux présentent des faces rectangulaires.
Les stries témoignent de la croissance cristalline par la répétition d'un même motif.
Par ailleurs, la cristallisation par chauffage est très lente (en comparaison avec celle du Chlorure de Sodium).


L'utilisation du logiciel MinUSc
(Minéraux à Usage Scolaire)
permet, comme pour la halite, de rechercher l'explication de ces propriétés à l'échelle moléculaire.
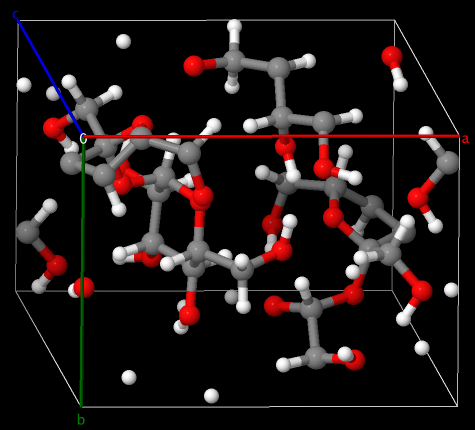
La maille est de type monoclinique (les arêtes sont de longueurs différentes, deux des trois angles sont droits).
Cette fois-ci la maille ne contient pas des atomes indépendants, mais des molécules. Les liaisons représentées
dans ce cas, sont des liaisons covalentes entre atomes.
La maille élémentaire ne contient pas de molécule de saccharose complète, mais uniquement des morceaux. Pour afficher
ces molécules complètes, il faut étendre l'affichage aux mailles voisines.
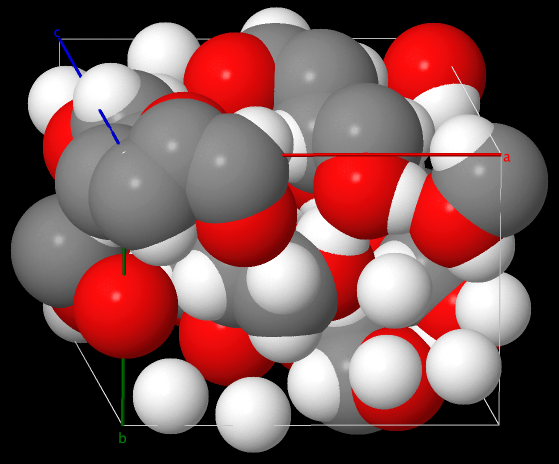
L'affichage en "Sphères" représente les atomes selon leur rayon de Van der Waals. Il permet de visualiser les contacts entre molécules.
L'affichage des charges est sans effet, ce qui montre que les forces électrostatiques n'interviennent pas ici comme dans un cristal ionique.
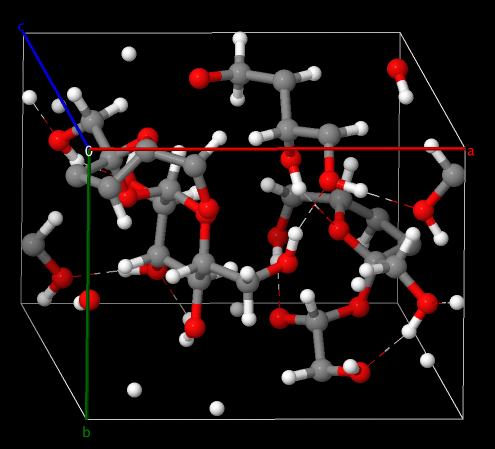
Des liaisons hydrogène existent entrent les molécules de saccharose. Chaque molécule établit une dizaine de liaisons de ce type avec ses voisines. Il existe aussi des liaisons intramoléculaires (2 liaisons entre atomes d'une même molécule de saccharose).
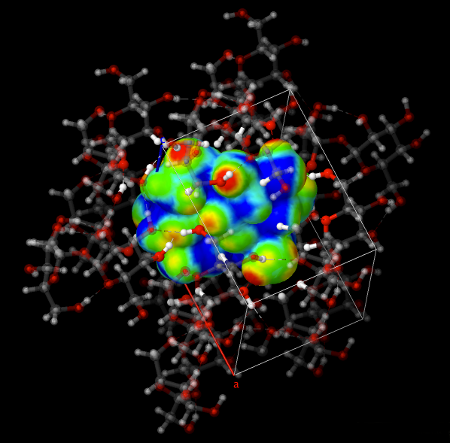
Ce mode de visualisation montre les contacts s'établissant sur une seule molécule. On peut constater que la
majeure partie de ces contacts implique des liaisons hydrogène.
D'autre part, ce mode de représentation met en évidence le volume occupé par une molécule de saccharose.
La comparaison avec le volume occupé par les unités des cristaux ioniques (des atomes isolés) est sans équivoque.

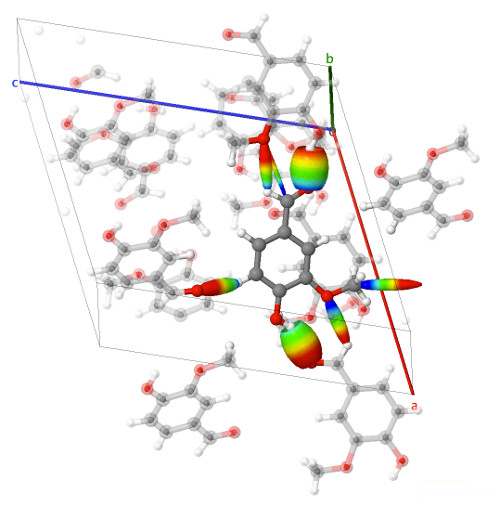
Les contacts sont répartis inégalement dans l'espace : absents dans une des trois directions du plan (la direction perpendiculaire au plan de l'écran sur cette image), il sont principalement orientés suivant un axe (vertical sur cette image) qui correspond à l'axe de croissance du cristal observé au microscope.
Remarque pour éviter les problèmes d'allergie liés à l'utilisation de la vanilline, il est possible de sceller les lames (voir ce lien).