par Julien Cartier
Une histoire de morues, de méduses et de pêcheurs
1. Bref historique de la pêche intensive
La première mention connue de la pêche au chalut date de 1376. Toutefois, jusqu’au début du 19ème siècle, les chalutiers étaient propulsés à la voile ce qui limitait leur rayon d’action aux zones côtières. Deux événements distincts vont alors provoquer une intensification de la pression de pêche. Tout d’abord le développement des chemins de fer, à partir des années 1830, lequel a accru la demande de produits maritimes (poissons, coquillages) par les populations urbaines de l’intérieur des terres. Cela s’est traduit par une généralisation du chalutage de fond. Puis, dans les années 1880, l’apparition des chalutiers à vapeur a considérablement étendu la surface des mers exploitée et cette extension s’est intensifiée après guerre. Entre 1950 et 2014 la distance moyenne entre les ports et les lieux de pêche de pays comme l’Espagne ou la Chine est passée de 2000 à 4000 km. Le nombre et la puissance des bateaux ont également augmenté, profitant de politiques de subventionnement. Les flottes de pêche exploitent désormais plus de 90 % de la superficie des mers et des océans, de sorte que seules certaines zones polaires demeurent épargnées.
2. Des signaux inquiétants
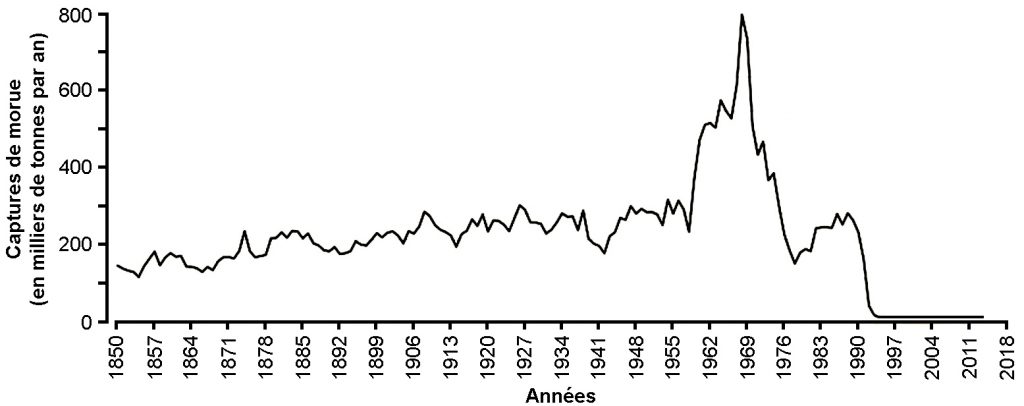
Pourtant, les captures ont cessé de progresser à la fin du 20ème siècle (fig.1). Et cela ne résulte pas d’une diminution de l’effort de pêche au profit de l’aquaculture. Au contraire, la pression de pêche a continué de s’accroître, mais les captures par unité de surface ont diminué de plus de 20 % depuis le milieu des années 1990. Et si l’on tient compte de l’ensemble des facteurs responsables de l’efficacité de la pêche (surface exploitée, taille des filets, capacités des bateaux, …) on estime que les prises par unité de puissance de pêche (LPUP) se sont réduites de plus de 90 % en un siècle. Cela indique que les poissons commerciaux se sont raréfiés. Diverses études suggèrent que la biomasse des grands poissons est inférieure à 10 % de son niveau préindustrielle.
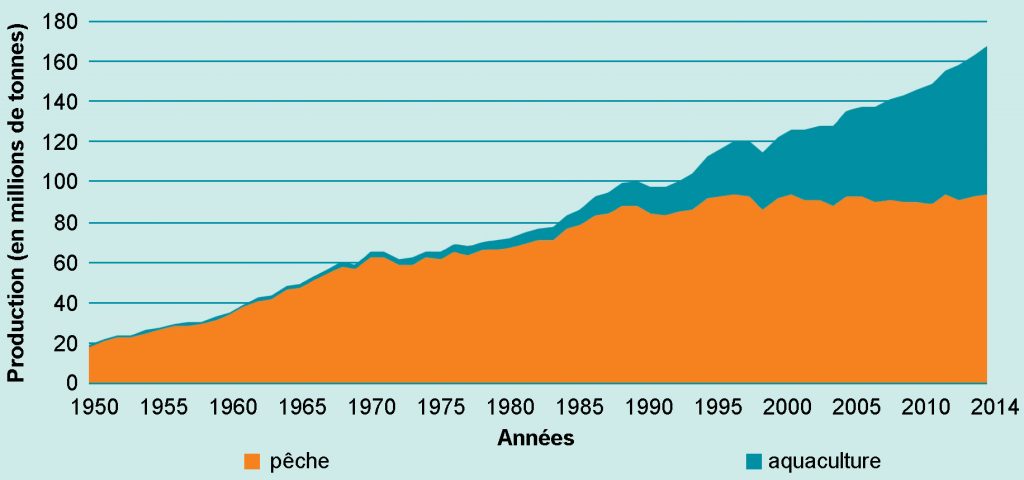
Fig.1 : variation de la production de poissons par la pêche et l’aquaculture entre 1950 et 2014 (source FAO 2016)
3. La surexploitation modifie les écosystèmes
La diminution des populations de poissons commerciaux n’est pas sans conséquence sur leurs écosystèmes. Si la surexploitation des ressources maritimes se manifeste à l’échelle globale, elle peut causer localement des modifications aussi profondes que durables.
3.a. Les huitres de la mer Baltique et le concept de biocénose
Et ce problème ne date pas d’hier puisqu’il est à l’origine du concept de biocénose dans la deuxième moitié du 19ème siècle. L’exemple mérite d’être rappelé. En 1869, le gouvernement prussien qui s’inquiète d’un épuisement des bancs d’huitres en mer Baltique, envoie le zoologiste Karl Möbius étudier le phénomène. Le chercheur comprend vite que l’arrivée du chemin de fer a provoqué un développement du marché et donc une surpêche responsable de l’épuisement des bancs. Cependant, il s’étonne que des animaux capables de produire des millions de gamètes ne parviennent pas à reconstituer rapidement leur effectif initial. Karl Möbius découvre alors que la raréfaction des huitres profite aux larves nageuses de moules et de coques. La prolifération de ces dernières prive les huitres des ressources dont elles auraient besoin pour se multiplier et ainsi empêche l’écosystème de retrouver son état d’origine. En 1877, Karl Möbius proposera le terme de biocénose pour désigner le fait qu’un milieu naturel est avant tout une communauté d’espèces en interactions.
3.b. Les morues de Terre-Neuve
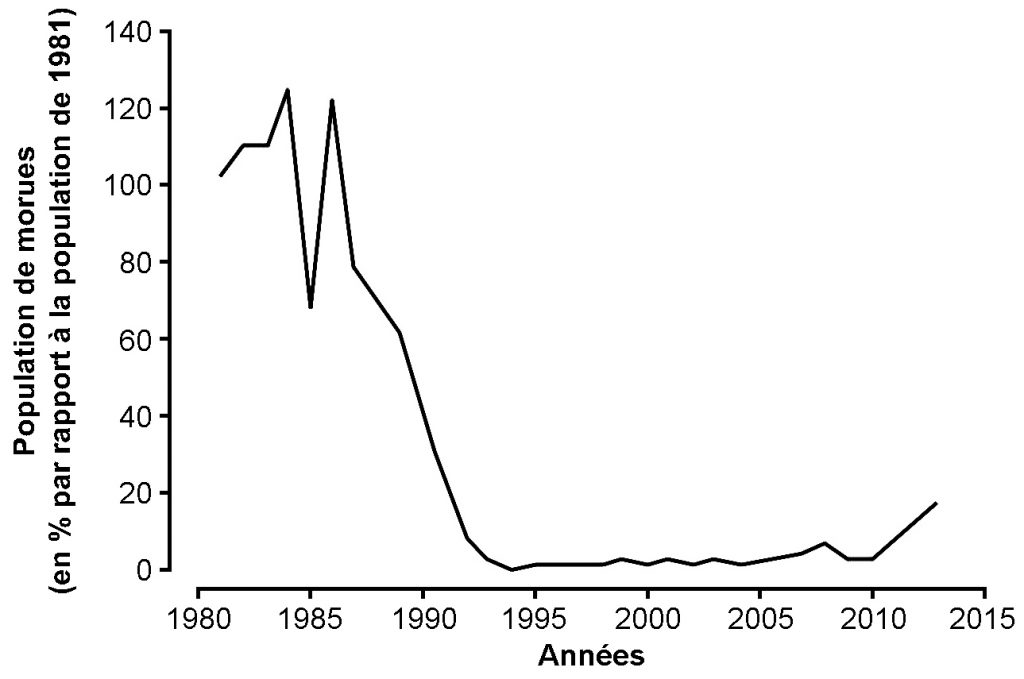
C’est une histoire similaire qu’a connu au début des années 1990 la zone de pêche de Terre-Neuve située au large du Canada. Depuis le 16ème siècle l’endroit était réputé pour sa richesse en morues (Gadus morhua), à tel point que les récits de marins décrivent une eau prenant la couleur du dos des poissons. Estimé à plus d’un million de tonnes, ce stock fournissait chaque année plus de 100 000 tonnes de morues (fig.2). Mais, dans les années 1960, l’augmentation du nombre et de la puissance des bateaux a entraîné une surpêche suivie d’un effondrement spectaculaire en 1991. La population résiduelle ne représente plus alors que 0,3 % du niveau initial, soit à peine quelques milliers de tonnes.
En 1992, un moratoire interdit la pêche de la morue. Les autorités et les scientifiques se veulent alors rassurants et pensent que deux ans suffiront pour voir le stock se reconstituer. Rien d’étonnant lorsqu’on sait qu’une seule morue peut pondre jusqu’à 11 millions d’œufs ! Malheureusement, ils se trompent. Alors que le moratoire dure toujours l’espèce commence à peine à montrer des signes de rétablissement (fig.3).
Les causes de ce retard sont multiples. En premier lieu, les morues ne pondent pas toutes 11 millions d’œufs. Cela n’est vrai que pour les plus gros spécimens qui sont aussi les plus vieux et évidemment les plus recherchés par les pêcheurs. Ainsi, lorsque le stock s’est effondré cela faisait longtemps que les grandes morues avaient disparu. Or, les animaux plus jeunes produisent trois fois moins d’œufs et le taux de survie de leurs larves est également plus faible. Le deuxième paramètre réside justement dans le taux de survie des larves, ou alevins. Ces derniers sont en effet la proie de nombreuses espèces, principalement des crustacés et de petits poissons de fond comme le capelan (Mallotus villosus), de sorte qu’on estime que seul un œuf sur un million aboutit à un adulte. Surtout, ces prédateurs de morues juvéniles ont largement profité de la disparition des morues adultes dont ils étaient eux-mêmes les proies. Devenus plus nombreux, ils dévorent suffisamment de larves de morues pour empêcher le stock de se reconstituer, figeant l’écosystème dans ce que les chercheurs appellent un « état stable alternatif ».
Remarquons que la diminution de la population de grands poissons va évidemment de pair avec la diminution du nombre de leurs œufs et de leurs larves ce qui devrait se répercuter négativement sur la population de petits poissons prédateurs. Mais ces derniers se nourrissent aussi des œufs d’autres espèces et de planctons.
3.c. Les méduses de Namibie
Un autre exemple de bascule d’un écosystème sous l’effet de la surpêche se rencontre sur les côtes de la Namibie. Une industrie de pêche à la sardine (Sardina pilchardus) y prospérait depuis les années 1950. Au moment de l’indépendance du pays en 1990, les stocks étaient épuisés et malgré des mesures de protection demeurent extrêmement faibles (fig.4).
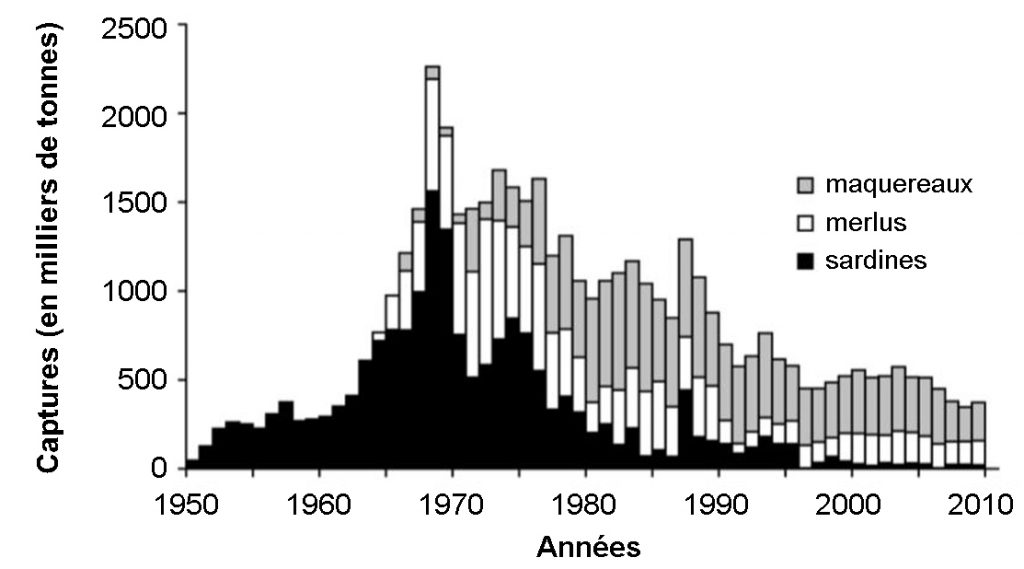
Fig.4 : variation des captures en Namibie de trois espèces de poissons commerciaux entre 1950 et 2010 (source Roux et al. 2013)
Outre l’accroissement de certaines populations de poissons comme le maquereau (fig.4), l’effondrement des stocks de sardines a coïncidé avec une prolifération de deux espèces de méduses, Aequorea forskalea et Chrysaora fulgida qui préexistaient dans l’écosystème. Les dernières estimations réalisées à l’aide de techniques acoustiques donnent le vertige : les 10 millions de tonnes de sardines qui peuplaient ces eaux dans les années 1960 ont laissé place à plus de 12 millions de tonnes de méduses, soit près de 2,5 fois la biomasse de l’ensemble des stocks de poissons commerciaux subsistants.
Ici aussi les proies se sont révélées être des prédateurs. Car si les sardines mangent les jeunes méduses, ces dernières consomment les œufs et les larves de sardines. Le couple sardine-méduse ressemble ainsi au couple morue-capelan évoqué précédemment. Mais, la pression exercée par les méduses sur les sardines ne se limite pas à la prédation des juvéniles. En effet, elles entrent également en compétition avec les alevins pour l’accès au zooplancton dont toutes deux se nourrissent. Pire, les grandes méduses ayant peu de prédateurs, leurs cadavres amènent une grande quantité de matière organique vers le fond marin où la décomposition bactérienne génère une hypoxie localisée. Une hypoxie à laquelle sont particulièrement sensibles les sardines.
3.d. L’état stable alternatif
Les trois exemples précédents montrent que la résilience d’un écosystème suite à une perturbation n’est pas garantie. Ils permettent aussi d’illustrer cette phrase du programme « il n’y a pas d’équilibre stable des écosystèmes mais des équilibres dynamiques ». Ainsi, un même écosystème peut présenter différents états de stabilité et une perturbation anthropique peut provoquer le basculement d’un état stable vers un autre, au-delà d’un certain seuil hélas difficilement prédictible.
On remarquera que la bascule vers un état stable alternatif repose notamment sur la faculté de certaines proies à devenir chasseurs. C’est le cas des capelans, proies des morues adultes mais prédateurs de leurs alevins. C’est également le cas des méduses, mangées par les sardines mais capables de se nourrir de leurs larves. Ce type de mécanisme de rétroaction semble spécifique aux environnements marins, ce qui le rend quelque peu contre-intuitif, car appliqué aux milieux terrestres c’est comme si les zèbres dévoraient les jeunes lions.
4. Le rôle du biotope
Les perturbations de la biocénose par la surpêche ne suffisent pas toujours à expliquer un changement d’état de l’écosystème. Dans le cas de Terre-Neuve l’effondrement coïncide également avec un refroidissement des eaux qui en diminuant la quantité de plancton disponible a entrainé la diminution des stocks de petits poissons (dont le capelan) dont se nourrissent les morues adultes et vraisemblablement augmenté la mortalité des larves et des œufs. Le réchauffement des eaux depuis le début des années 2000 explique d’ailleurs pour partie le lent rétablissement du stock de morue.
Il y a là une explication au retour vers l’état de stabilité initial de l’écosystème ce qui pourrait contredire la notion même d’état de stabilité alternatif. En effet, les espèces prédatrices des œufs et des juvéniles sont multiples et leur alimentation varie en fonction des conditions du biotope, en particulier la température. Par exemple, on sait qu’en février, lorsque les morues se reproduisent, le hareng de l’Atlantique (Clupea harengus) se nourrit essentiellement d’œufs de morue. Mais, lorsqu’au printemps les eaux commencent à se réchauffer les copépodes se multiplient et les harengs délaissent les œufs pour se repaître de ces petits crustacés.
5. Une grave diminution des services écosystèmiques
5.a. L’effondrement de l’industrie de pêche
Quand le 2 juillet 1992, le ministre canadien de la pêche décrète un moratoire sur l’exploitation de la morue de Terre-Neuve, plus de 30 000 pêcheurs se retrouvent instantanément au chômage. 12 000 autres les rejoindront l’année suivante lorsque l’interdiction sera étendue à tout le golfe du Saint-Laurent. S’y ajoutent les faillites des entreprises spécialisées dans le traitement des poissons, telles que les usines de conserves. Un tel drame prend une ampleur encore plus grande lorsqu’il affecte un pays pauvre comme la Namibie dont la pêche représente plus de 5 % du PIB et 30 % des exportations. Cela doit nous inciter à nuancer les espoirs que peuvent susciter auprès des élèves les exemples de reconstitution des stocks. Le temps que ces rétablissements se produisent c’est toute une économie qui s’est effondrée.
5.b. Le fléau des méduses
La pullulation des méduses ne fait pas seulement disparaître certaines espèces de poissons commerciaux, elle perturbe aussi la pêche des espèces subsistantes en provoquant l’éclatement des filets et en contaminant les prises. Les méduses s’attaquent également aux poissons d’élevage et entraînent la fermeture des plages ce qui pénalise l’industrie touristique. Elles peuvent même boucher les systèmes de refroidissement des centrales électriques côtières.
Enfin, la pêche participe à l’introduction d’espèces de méduses invasives, car l’eau des ballasts ou les coques des bateaux transportent sur de longues distances les polypes et les larves de cnidaires. C’est la prolifération d’une méduse invasive qui a provoqué la disparition de l’industrie du caviar de Béluga en mer Caspienne, ainsi qu’une forte diminution des populations d’esturgeons et d’anchois. La même méduse a depuis envahi la mer Baltique et la mer du Nord. Et c’est une méduse originaire de l’océan Pacifique qui détruit les filets à crevettes dans le golfe du Mexique.
Mais, certaines pullulations de méduses ne résultent pas directement de la surpêche. Ainsi, on sait que l’eutrophisation des eaux générée par le lessivage des terres agricoles, et le réchauffement climatique, favorisent la prolifération de ces espèces.
Attention, toutefois, à ne pas diaboliser les méduses. Ce sont des composants essentiels des écosystèmes puisqu’au moins 124 espèces de poissons et 34 espèces d’autres animaux s’en nourrissent, comme la tortue Luth (Dermochelys coriacea) en danger critique d’extinction. Paradoxalement, elles offrent également un refuge à de nombreuses sortes d’alevins. Enfin, elles représentent une importante ressource halieutique puisque chaque année plus de 400 000 tonnes sont récoltées pour la consommation humaine en Asie du Sud-Est. 15 pays possèdent ainsi des pêcheries à méduses dont la Chine, l’Inde, l’Indonésie, le Japon, la Malaisie et les Philippines.
5.c. Une menace pour la biodiversité
L’effondrement d’un stock de poissons s’accompagne généralement d’une cascade trophique responsable de la diminution des populations de plusieurs autres espèces. Par exemple, en Namibie, la raréfaction des sardines a mis en danger certaines espèces d’oiseaux emblématiques comme le manchot du Cap (Spheniscus demersus), victime de la disparition de sa principale source d’alimentation.
6. L’efficacité des mesures de gestion
L’Afrique du sud présente une zone de pêche très similaire à celle de la Namibie. On y rencontre approximativement les mêmes espèces et elles bénéficient toutes deux d’upwelling favorables à la croissance du plancton dont se nourrissent les sardines. Mais, lorsque le stock a commencé à s’effondrer au début des années 1960, le gouvernement d’Afrique du sud a réagi en imposant des quotas de pêche définis grâce à une politique de recherche visant à mieux comprendre la dynamique de l’écosystème (fig.5). À l’inverse, le gouvernement namibien n’a pas écouté les appels lancés par des scientifiques, au début des années 1980, pour réclamer un moratoire sur l’exploitation de la sardine. On connaît la suite.
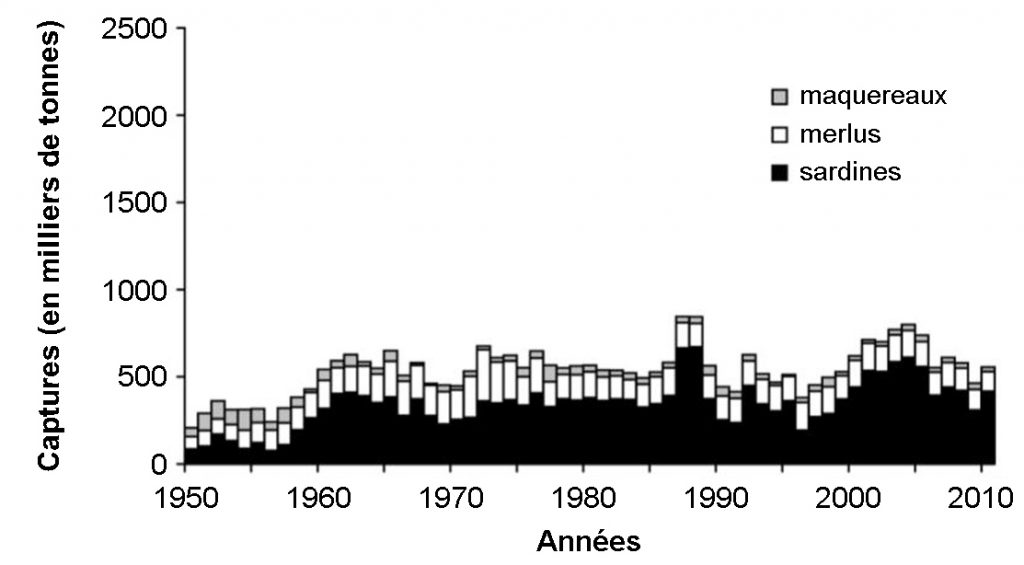
Fig.5 : variation des captures en Afrique du sud de trois espèces de poissons commerciaux entre 1950 et 2010 (source Roux et al. 2013) – à comparer à la fig.4
Malheureusement, ce type de mises en garde tend à se multiplier. Non sans raison puisqu’on estime qu’actuellement près de 90 % des stocks de poissons commerciaux sont surexploités.
7. Modéliser ces phénomènes
Les nouveaux programmes de lycée encouragent la modélisation des systèmes biologiques. Le chapitre « Écosystèmes et services environnementaux » qui figure dans le programme de spécialité de première s’y prête tout particulièrement et l’on trouvera d’ailleurs sur ce site d’autres exemples de modèles destinés à traiter ces notions.
Lien vers l’article Modéliser la dynamique et la résilience d’une forêt mixte (chênaie/hêtraie)
https://www.pedagogie.ac-nice.fr/svt/?p=1096
Les écosystèmes marins permettent tout à la fois de présenter des phénomènes de résilience et des phénomènes de bascule vers des états stables alternatifs. Cette activité se justifie d’autant plus que les scientifiques utilisent abondamment les modèles numériques pour tester leurs hypothèses concernant l’évolution des différentes populations de ces milieux.
7.a. Un modèle simple permettant d’illustrer la résilience et l’enjeu de la gestion de la pêche
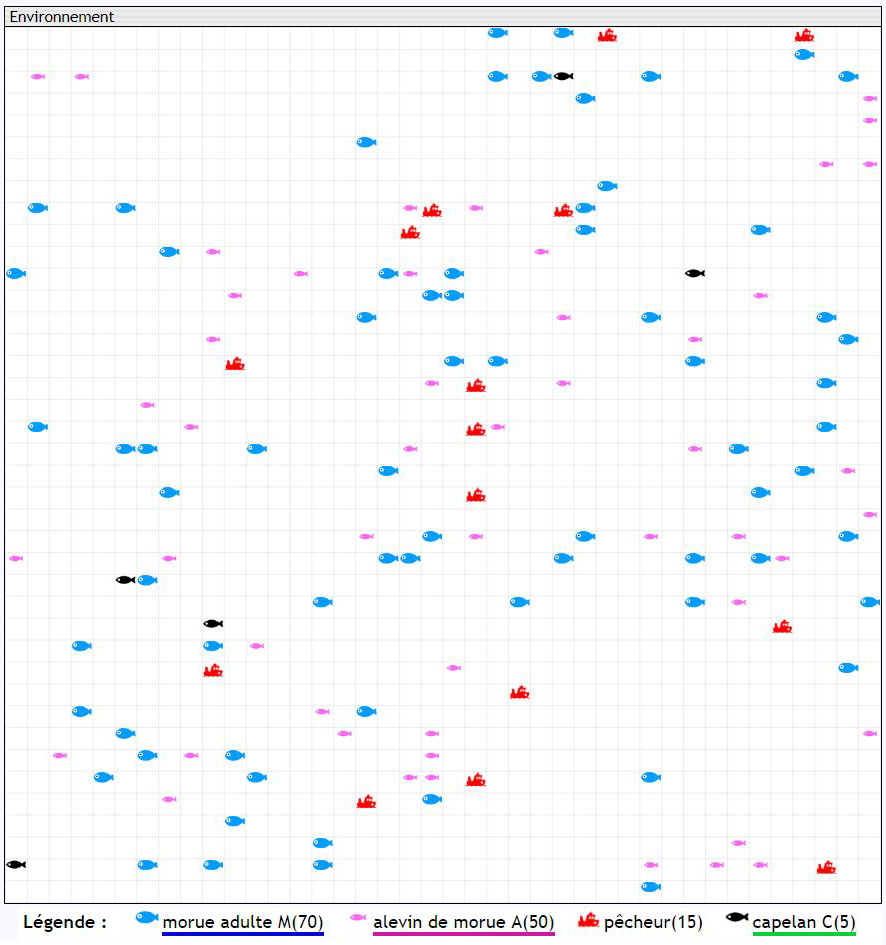
Le premier modèle réunit des morues adultes, leurs alevins, des capelans et des bateaux de pêche (fig.6).
Dans un premier temps on peut considérer un modèle simplifié où ne figurent que les morues et leurs alevins. Pour cela il suffit de suspendre toutes les règles relatives à la pêche et aux capelans (fig.7).
Ce système est stable dans un état où l’effectif des morues adultes demeure continuellement supérieur à celui de leurs alevins, malgré des variations synchrones (fig.8).
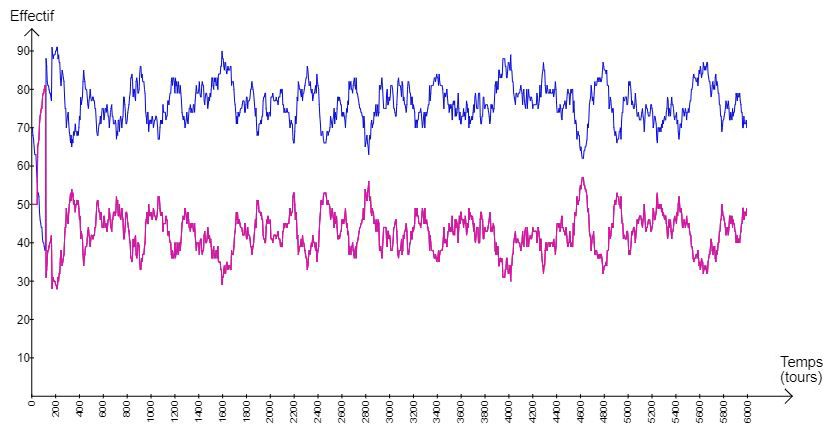
Fig.8 : graphique présentant les résultats de la modélisation durant 6000 tours (en bleu les morues, en rose leurs alevins)
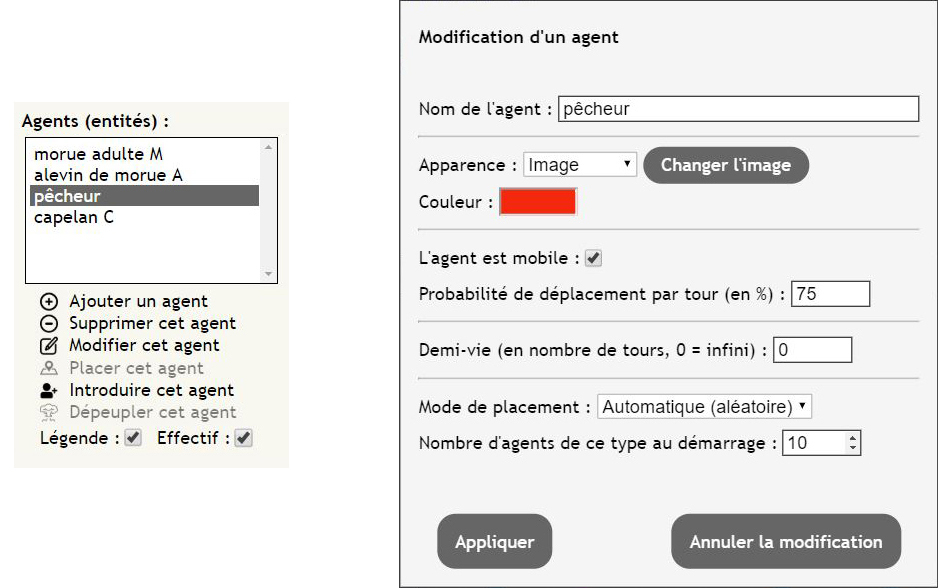
On peut ensuite observer l’impact d’une campagne de pêche modérée. On commence par modifier le nombre de pêcheurs en double cliquant sur le mot « pêcheur » dans la rubrique « Agents (entités) », puis on rentre « 10 » dans la case correspondant au « Nombre d’agents de ce type au démarrage ». On lance le modèle puis on réactive la règle « pêche » au bout de 1000 tours, avant de la suspendre à nouveau après 4000 tours (fig.9.a. et 9.b.)
La pêche provoque une diminution du nombre de morues, mais dès l’arrêt du prélèvement le stock se reconstitue très rapidement. Cependant, si l’on augmente la pression de pêche en plaçant dans le modèle 20 pêcheurs et non 10, le stock s’effondre au point que l’espèce disparaît (fig.10).
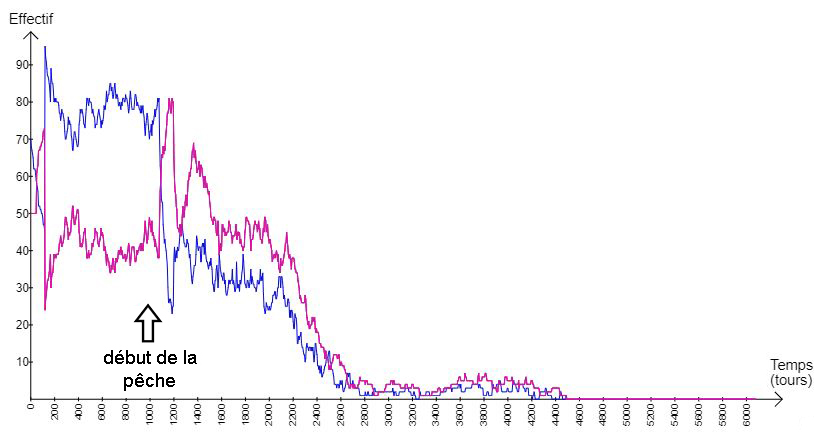
Fig.10 : graphique présentant les résultats de la modélisation avec 20 pêcheurs durant 6000 tours, sans interruption de la pêche
Néanmoins, il suffit d’interrompre la pêche avant l’extinction de l’espèce pour observer un phénomène de résilience (fig.11).
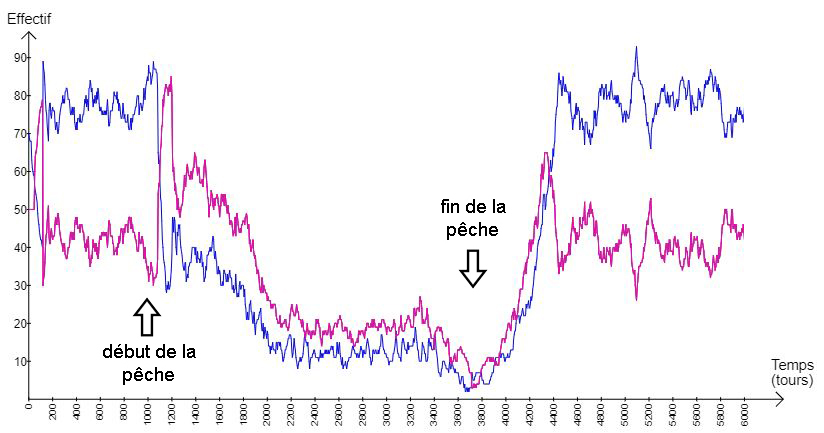
Fig.11 : graphique présentant les résultats de la modélisation avec 20 pêcheurs durant 6000 tours, avec interruption de la pêche
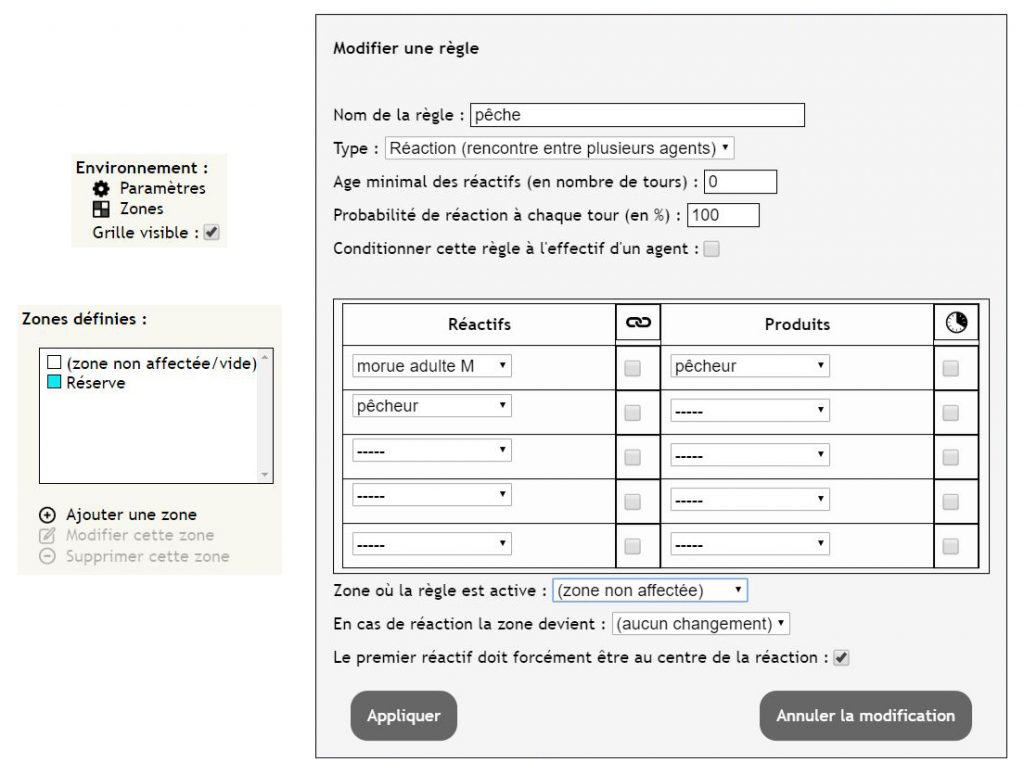
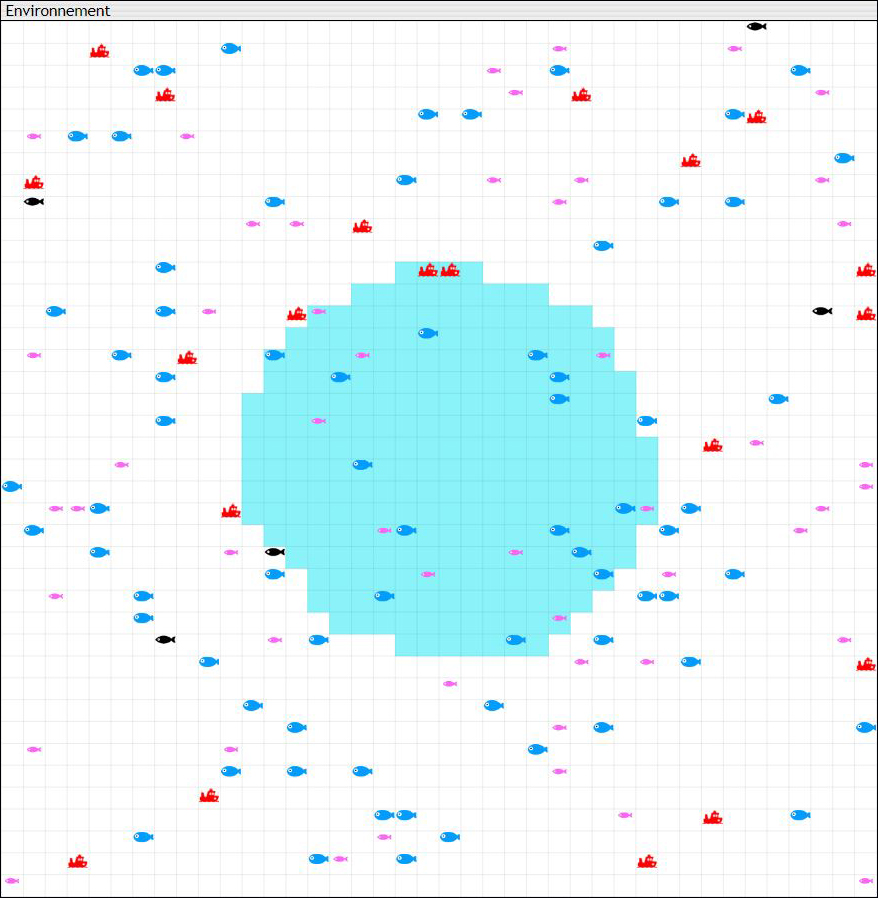
Une autre façon de préserver l’espèce consiste à créer une réserve où la pêche est interdite. Pour cela il faut cliquer sur l’onglet « Zone » dans la rubrique « Environnement ». On clique ensuite sur « Ajouter une zone » et on la trace sur le modèle à l’aide des outils de dessin proposés. Enfin, on se rend dans la règle régissant la pêche et dans la case « Zone où la règle est active » où l’on sélectionne « (Zone non affectée) » (fig.12).
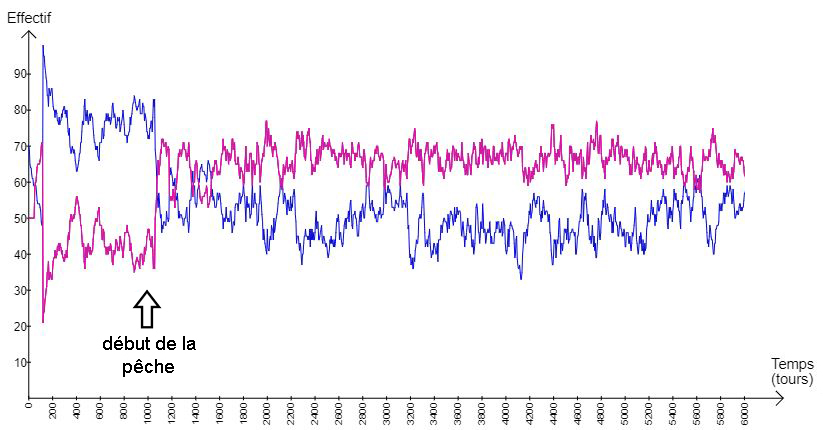
Fig.12.c : graphique présentant les résultats de la modélisation avec 20 pêcheurs autour de la réserve, durant 6000 tours, sans interruption de la pêche
7.b. Un modèle plus complexe permettant d’illustrer la bascule vers un état stable alternatif
On peut à présent supprimer la réserve et réactiver toutes les règles concernant les capelans. Ces règles sont relativement simples :
• les morues adultes mangent les capelans
• les capelans mangent les alevins de morue
• les capelans se reproduisent
En l’absence de pêche cet écosystème est stable (fig.13).
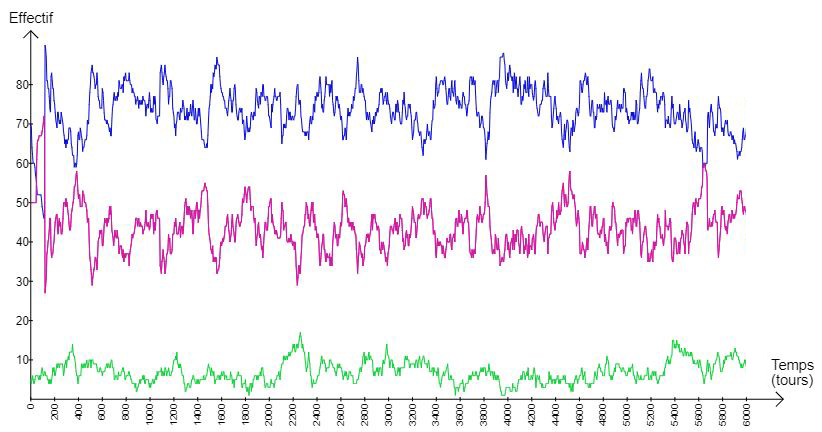
Fig.13 : graphique présentant les résultats de la modélisation durant 6000 tours (en vert les capelans)
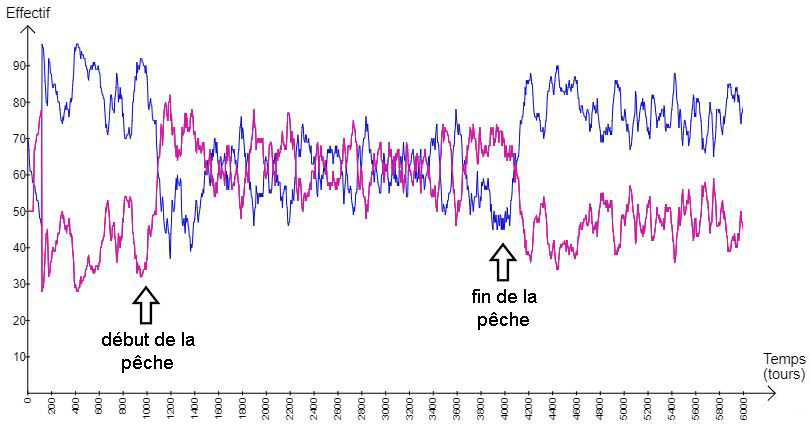
Dans ces conditions, la pêche provoque simultanément une diminution du stock de morue et une augmentation de la population de capelans. Mais, ici, l’interruption de la pêche, lorsque les morues menacent de disparaître, n’est pas suivie pas une reconstitution du stock. Au contraire, l’effectif des morues et de leurs alevins demeure aussi faible que celui des capelans reste élevé (fig.14).
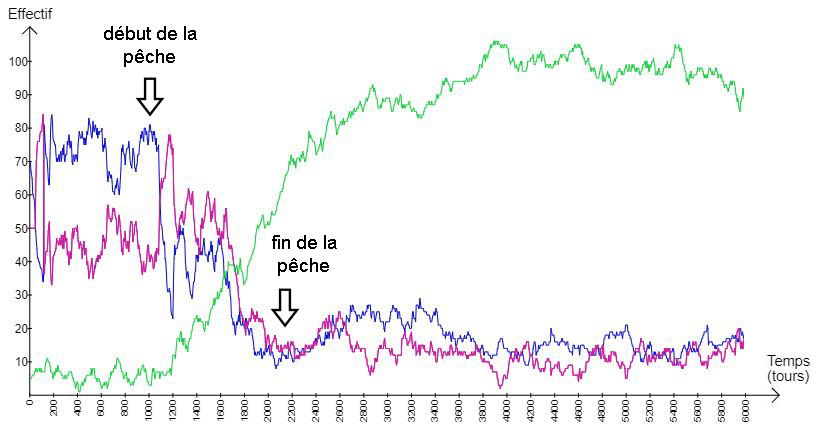
Fig.14 : graphique présentant les résultats de la modélisation avec 20 pêcheurs durant 6000 tours, avec interruption de la pêche
Cependant, ce basculement vers un état stable alternatif n’est pas systématique. Si on tarde trop à suspendre la pêche les morues disparaissent (fig.15). À l’inverse, si la pêche s’arrête avant que le stock de morues ne soit devenu suffisamment faible on assiste à un phénomène de résilience plus ou moins rapide (fig.16).
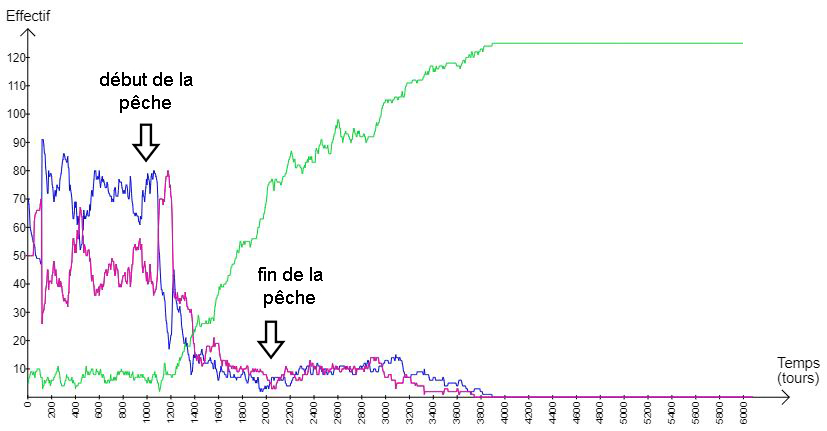
Fig.15 : graphique présentant les résultats de la modélisation avec 20 pêcheurs durant 6000 tours, avec interruption de la pêche tardive
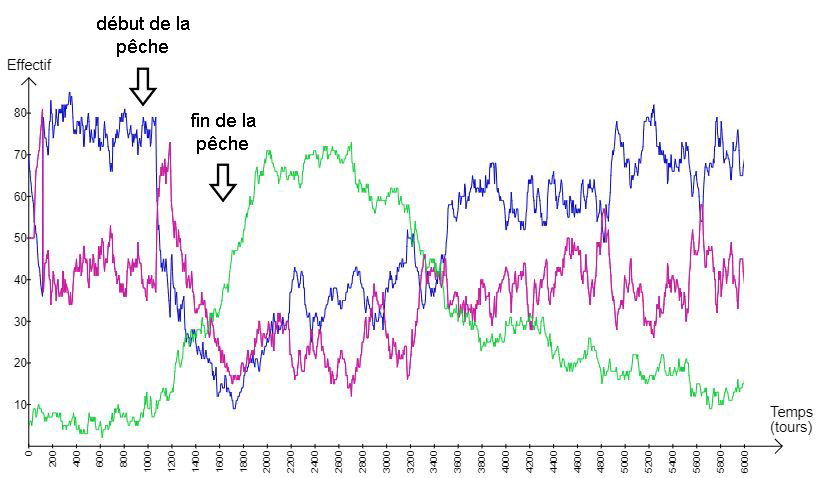
Fig.16 : graphique présentant les résultats de la modélisation avec 20 pêcheurs durant 6000 tours, avec interruption de la pêche précoce
7.c. Un modèle alternatif avec le couple méduses-sardines
Dans ce modèle les morues sont remplacées par les sardines, tandis que les méduses jouent le rôle des capelans (fig.17). En revanche, les règles appliquées à chaque type d’agents ne changent pas.
7.d. Limites des modèles utilisés
Il convient de garder à l’esprit que ces modèles ont été conçus pour un usage pédagogique. Leurs règles de fonctionnement reposent sur des simplifications volontaires qui les différencient des modèles utilisés par les scientifiques en charge de l’étude des ressources halieutiques.
Par exemple, les méduses apparaissent par génération spontanée, de sorte que l’espèce ne peut jamais s’éteindre. Toutefois, la capacité des polypes à s’enkyster durant de longues périodes, à se régénérer à partir de fragments et à proliférer par bourgeonnement, justifie ce mode de génération.
En revanche, ce type de génération ne devrait pas s’appliquer aux capelans. En réalité, il est très rare qu’une espèce marine disparaisse complètement. Dans le cas des morues ou des harengs de l’Atlantique nord on sait que les disparitions constatées localement allaient de pair avec la persistance de populations des mêmes espèces dans des territoires proches. Dès l’arrêt des perturbations, ou simplement lorsque celles-ci diminuaient d’intensité, ces populations repeuplaient les zones désertées.
La génération des morues et des sardines est également simplifiée de manière à ne pas nécessiter la rencontre de deux poissons. En effet, Edu’modèle ne réunit pas les agents sous forme de bancs ce qui ne permet pas de modéliser convenablement la reproduction de ces espèces.
Enfin, la prédation des capelans sur les alevins de morues et la prédation des méduses sur les alevins de sardines sont volontairement suspendues lorsque le nombre de larves devient inférieur à 10. Cela évite que l’espèce ne disparaisse et réciproquement autorise l’installation d’un état stable alternatif. Cette règle n’est d’ailleurs pas si artificielle dans la mesure où les prédateurs ont tendance à changer de proie lorsque l’effectif de ces dernières devient trop faible. Par ailleurs, les milieux marins renferment des abris naturels, sorte de réserve où la prédation ne s’exerce pas comme en pleine eau.
8. En conclusion
Dans le cadre d’une pédagogie s’appuyant sur la démarche scientifique il importe de légitimer le recours à ces modèles numériques plutôt que de se contenter d’imposer leur usage sans justification préalable. Cela implique de concevoir un problème nécessitant la modélisation de l’écosystème. Voici deux exemples de situations déclenchantes :
Situation n°1 : La région X exploite la morue depuis des décennies. Pourtant, certaines personnes s’alarment de la diminution du nombre de prises. Ils ont entendu dire que la surpêche a causé l’effondrement du stock de morues au large des côtes canadiennes de Terre-Neuve et que ce stock ne se reconstitue pas malgré l’interdiction totale de la pêche. Craignant qu’un phénomène similaire ne se produise dans la région X, ces personnes proposent d’instaurer des quotas de pêche afin de réduire le prélèvement de morues. Mais, la plupart des pêcheurs de la région X ne sont pas d’accord. Ils savent qu’ils pêchent moins de morues que leurs confrères canadiens. Selon eux, cela devrait suffire à éviter l’épuisement du stock. De surcroît, ils ont appris qu’une seule morue peut pondre jusqu’à 11 millions d’œufs. Sachant cela ils ne croient pas que la population de Terre-Neuve soit incapable de se reconstituer naturellement. Ils suspectent les pêcheurs canadiens de faire du braconnage, autrement dit de pêcher illégalement, empêchant ainsi le retour des poissons.
Situation n°2 : La région Z exploite la sardine depuis des décennies. Pourtant, certaines personnes s’alarment de la diminution du nombre de prises et de la prolifération des méduses. Ils ont entendu dire que la surpêche a causé l’effondrement du stock de sardines au large des côtes namibiennes et leur remplacement par d’innombrables méduses. Craignant qu’un phénomène similaire ne se produise dans la région Z, ces personnes proposent d’instaurer des quotas de pêche afin de réduire le prélèvement de sardines. Mais, la plupart des pêcheurs de la région Z ne sont pas d’accord. Ils savent qu’ils pêchent moins de sardines que leurs confrères namibiens. Selon eux, cela devrait suffire à éviter l’épuisement du stock. De surcroît ils ont appris qu’une seule sardine peut pondre plusieurs millions d’œufs et que ces poissons se nourrissent de méduses. Sachant cela ils ne croient pas que la population de Terre-Neuve soit incapable de se reconstituer naturellement. Ils suspectent les pêcheurs namibiens de faire du braconnage, autrement dit de pêcher illégalement, empêchant ainsi le retour des poissons. Quant à la pullulation des méduses ils rappellent qu’il s’agit d’un phénomène normal qui a toujours existé.
Ces exemples permettent d’introduire le modèle comme une représentation du réel et non le réel lui-même, c’est-à-dire un outil au service de la compréhension des faits. Ainsi, ces modélisations n’ont de sens que si elles s’accompagnent d’informations sur le fonctionnement des différentes composantes de l’écosystème.
En fonction du temps dont on dispose et du niveau des élèves, on peut confier à ces derniers une part plus ou moins grande du travail de paramétrage du modèle. Car si le travail de conception revêt un intérêt certain, il n’est pas nécessaire de créer le modèle pour accéder aux connaissances qu’il représente. Son exploitation bien comprise peut suffire à découvrir que la complexité des relations interspécifiques conditionne des équilibres dynamiques dont nous sommes partie prenante.
Cette surprenante complexité des écosystèmes et l’apparente imprévisibilité de leurs dynamiques constituent des curiosités remarquables, autant que des objets d’études scientifiques en raison des enjeux majeurs qu’ils représentent. Voulant sans doute faire référence à ce double aspect fascinant de la nature, l’historien des sciences Jean-Marc Drouin cite dans son ouvrage L’écologie et son histoire (éd. Flammarion, 1991) ces vers du poète Jacques Delille :
Ils sont passés ces temps des rêves poétiques,
Où l’Homme interrogeait des forêts prophétiques,
Où la fable créant des faits prodigieux,
Peuplait d’êtres vivants des bois religieux […]
Tout est désenchanté, mais sans tous ces prestiges,
Les arbres ont leur vie, et les bois leurs prodiges.
LIENS VERS LES 2 MODÈLES
BIBLIOGRAPHIE
Publications scientifiques
• Far from home : Distance patterns of global fishing fleets, D. Tickler et al., Science Advances, 2018
• Signatures of the collapse and incipient recovery of an over exploited marine ecosystem, E.J.Pedersen et al. Royal Society, 2017
• The state of world fisheries and aquaculture, FAO, 2016
• Jellyfication of marine ecosystems as a likely consequence of overfishing small pelagic fishes : lessons from the benguela, J-P. Roux et al., Bulletin of marine science, 2013
• Role of egg predation by haddock in the decline of an Atlantic herring population, D. E. Richardson et al. PNAS, 2011
• The effects of 118 years of industrial fishing on UK bottom trawl fisheries, R. H. Thurstan et al., Nature Communications, 2010
• Predator–prey reversal: A possible mechanism for ecosystem hysteresis in the North Sea ? P. Fauchald, Ecology, 2010
• The jellyfish joyride: causes, consequences and management responses to a more gelatinous future, A.J. Richardson et al, Cell, 2009
Articles de vulgarisation
• Alerte mondiale à la surpêche, Denis Delbecq, Le Temps, 15/10/2018
• La morue de Terre-Neuve est de retour ! Loïc Chauveau, Sciences et Avenir, 2015
• La surpêche alimente la prolifération des méduses, AFP, Sciences et Avenir, 2013
• Les méduses, principales bénéficiaires de la surpêche, Yves Miserey, Le Figaro, 2010
• L’édifiante histoire de la disparition de la morue, Olivier Milhomme, Science & Vie, mars 2006
Livre
• Pour une révolution dans la mer, de la surpêche à la résilience, Didier Gascuel, éd. Actes Sud, 2019
EXTRAITS DU PROGRAMME DE SPÉCIALITÉ DE PREMIÈRE (BO spécial du 22 janvier 2019)
Seuls sont mentionnés les phrases de ce chapitre pouvant être abordées à travers les exemples développés précédemment.
Thème 2 – Enjeux contemporains de la planète
Écosystèmes et services environnementaux
Les écosystèmes : des interactions dynamiques entre les êtres vivants et entre eux et leur milieu
Les écosystèmes sont constitués par des communautés d’êtres vivants (biocénose) interagissant au sein de leur milieu de vie (biotope). La biocénose est en interaction avec le biotope. La diversité des interactions biotiques s’étudie à la lueur de leur effet sur la valeur sélective des partenaires : compétition, exploitation. Ces interactions structurent l’organisation (biodiversité de l’écosystème), l’évolution (dynamique des populations) et le fonctionnement de l’écosystème (production, flux de matière et réservoirs, recyclage de la matière organique, etc.). La complexité du réseau d’interactions et la diversité fonctionnelle favorisent la résilience des écosystèmes, qui jusqu’à un certain seuil de perturbation, est la capacité de retrouver un état initial après perturbation. Les élèves apprennent qu’il n’y a pas d’équilibre stable des écosystèmes mais des équilibres dynamiques susceptibles d’être bousculés.
L’humanité et les écosystèmes : les services écosystémiques et leur gestion
L’espèce humaine affecte le fonctionnement de la plupart des écosystèmes en exploitant des ressources, en modifiant le biotope local (ex. eutrophisation) ou global (ex. changement climatique). Beaucoup d’écosystèmes mondiaux sont impactés, avec une perte mondiale de biodiversité et des conséquences néfastes pour les activités humaines. La connaissance scientifique des écosystèmes (l’écologie) peut permettre une gestion rationnelle des ressources exploitables, assurant à la fois l’activité économique et un maintien des services écosystémiques.
Remerciements
Je remercie chaleureusement M. Jules Selles, docteur en sciences économiques halieutique, chargé de mission modélisateur Halieute au Muséum National d’Histoire Naturelle, qui a grandement participé à la sélection des sources bibliographiques de ce travail.