par Philippe Cosentino
Dans cet article nous vous présenterons les fonctionnalités du logiciel en ligne « Diastase 2 », qui permet, à l’instar de son prédécesseur « Lactase », de modéliser la catalyse enzymatique.
Contexte
Avec la désactivation progressive de « Flash » (technologie très utilisée dans les années 2000 pour réaliser des applications web interactives), beaucoup de petits logiciels pédagogiques cessent de fonctionner sur nos machines modernes.
C’est le cas du logiciel « Lactase », qui permettait de modéliser la catalyse enzymatique., et qui était très utilisé dans le cadre de l’enseignement de spécialité de première.
« Diastase », application web écrite en HTML5/Javascript s’inscrit dans la continuité de « Lactase ».
Présentation du logiciel
Diastase repose sur une modélisation multi-agents (les agents étant ici les molécules), simulant le déroulement d’une réaction enzymatique.
On visualise à l’écran le déplacement des molécules, leur rencontre, la formation des complexes et leurs dissociations.
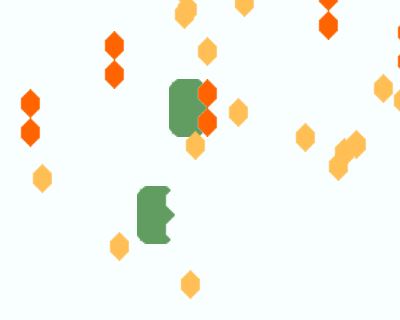
Représentation des molécules dans Diastase (en vert la maltase, en orange clair le maltose, en orange foncé le glucose).
On peut également suivre, à l’aide d’un graphique, l’évolution des effectifs des différentes molécules.
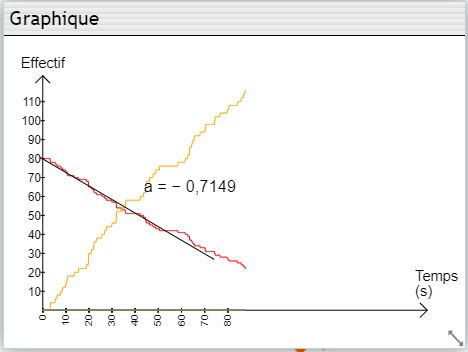
Graphique montrant l’évolution du nombre de molécules. Il est possible de tracer une tangente avec la souris afin de déterminer sa pente (vitesse initiale).
L’utilisateur peut faire varier :
- le pH (lorsque ce dernier s’écarte du point isoélectrique des enzymes, elles se polarisent ce qui diminue la probabilité de formation du complexe)
- la température (la vitesse d’agitation des molécules en dépend, ainsi que la probabilité de dénaturation des enzymes)
- les effectifs des différentes espèces moléculaires
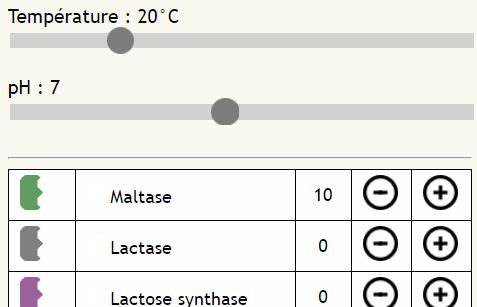
Extrait de l’interface de Diastase. Température et pH peuvent être ajustés à l’aide d’un curseur. Les boutons + et – permettent de rajouter ou de soustraire des molécules. Il est également possible de saisir directement un nombre en cliquant sur la valeur de l’effectif.
Lorsque le pH est très bas, une hydrolyse non enzymatique des diholosides (lactose, maltose) a lieu, mais elle est bien plus lente (surtout à basse température) qu’en présence d’enzymes.
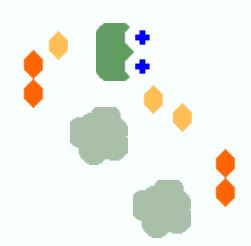
Un pH très bas (ou très haut) ne fera pas qu’entraîner la polarisation des enzymes. Il pourra également entraîner leur dénaturation (en gris).
Il est également possible de partager une configuration (effectifs, pH, température) via un lien (URL), en cliquant sur le bouton « Partager via un lien » situé en bas à gauche de l’écran (à droite du bouton pause). En donnant ce lien à un élève, ce dernier pourra travailler sur un environnement donné (voir exemples à la fin de l’article).
Lorsqu’on clique sur « Partager via un lien », cette fenêtre de dialogue apparaît et propose deux liens de partage différents (le premier lance directement l’animation).
Utilisation dans le cadre de la continuité pédagogique
Grâce à sa fonctionnalité de « partage via un lien », ce logiciel se prête tout particulièrement au « télétravail ».
L’enseignant peut très facilement « montrer » à ses élèves une situation particulière, en leur communiquant un lien de partage comme celui-ci (hydrolyse enzymatique du lactose en présence d’un inhibiteur).
A l’inverse, il peut recueillir des réponses ou des propositions émanant des élèves via ce lien de partage. Par exemple, il a été demandé à des élèves de première (spécialité SVT), de rechercher l’enzyme, le substrat et les conditions optimales permettant la synthèse de lactose. Les élèves ont ensuite fait parvenir à leur enseignant leur proposition de réponse sous la forme d’un lien de partage, comme dans l’exemple suivant (l’exemple donné par l’élève ici est critiquable, ce dernier ayant laissé la température et le pH par défaut de 20°C et de 7, les conditions ne sont donc pas optimales).
Liens
Lien vers l’application Diastase en ligne
Lien vers l’application hors ligne (dossier web à télécharger)

